SIFAT KOLIGATIF
A. Molalitas dan Fraksi Mol
1. Molalitas (m)
Molalitas menyatakan jumlah mol zat terlarut dalam 1000 gram pelarut. Molalitas dapat dinyatakan dengan rumus:

2. Fraksi Mol (X)
Fraksi mol menyatakan perbandingan mol suatu zat dengan mol seluruh zat dalam larutan. Dalam campuran zat dengan zat B, maka fraksi mol masing-masing zat dapat dinyatakan dengan:
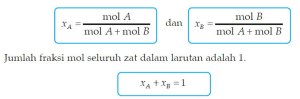
B. Penurunan Tekanan Uap ( P)
Bila kita memanaskan air (atau zat yang dapat menguap lainnya) dalam ketel yang tertutup, maka ketika air endidih tutup ketel dapat terangkat, mengapa hal ini terjadi? Apa sebenarnya yang menekan tutup ketel tersebut, air atau uap airnya? Dalam ruang tertutup air akan menguap sampai ruangan tersebut jenuh, yang disertai dengan pengembunan sehingga terjadi kesetimbangan air dengan uap air.
H2O(l) à H2O(g)
Terjadinya uap air ini akan menimbulkan tekanan sehingga menekan
ketel. Ketika air mendidih (suhu 100°C) banyak air yang menguap sehingga
tekanan yang ditimbulkan lebih besar hingga tutup ketel terangkat.
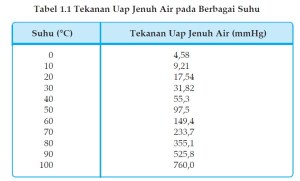
Tekanan yang ditimbulkan oleh uap jenuh air ini disebut tekanan uap jenuh air.Besarnya tekanan uap jenuh untuk setiap zat tidak sama, bergantung pada jenis zat dan suhu. Zat yang lebih sukar menguap, misalnya glukosa, garam, gliserol memiliki uap yang lebih kecil dibanding zat yang lebih mudah menguap, misalnya eter.
Bila suhu dinaikkan, energi kinetik molekul-molekul zat bertambah sehingga semakin banyak molekul-molekul yang berubah menjadi gas akibatnya tekanan uap semakin besar. Perhatikan tekanan uap jenuh air pada berbagai suhu pada Tabel berikut :
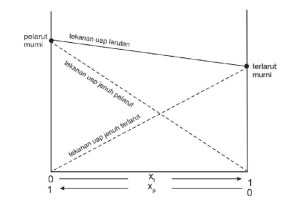
Apa yang terjadi terhadap tekanan uap bila ke dalam air (pelarut) ditambahkan zat terlarut yang sukar menguap? Bila zat yang dilarutkan tidak mudah menguap, maka yang menguap adalah pelarutnya, sehingga adanya zat terlarut menyebabkan partikel pelarut yang menguap menjadi berkurang akibatnya terjadi penurunan tekanan uap. Jadi, dengan adanya zat terlarut menyebabkan penurunan tekanan uap. Dengan kata lain tekanan uap larutan lebih rendah dibanding tekanan uap pelarut murninya. Penurunan tekanan uap yang terjadi merupakan selisih dari tekanan uap jenuh pelarut murni (P°) dengan tekanan uap larutan (P).
Tekanan uap larutan ideal dapat dihitung berdasar hukum Raoult “ Tiap komponen dalam suatu larutan melakukan tekanan yang sama dengan fraksi mol kali tekanan uap dari komponen (pelarut) murni”.

Dari rumus di atas apa yang dapat Anda simpulkan tentang hubungan penurunan tekanan uap dengan fraksi mol zat terlarut? Hubungan tekanan uap jenuh larutan dengan tekanan uap jenuh komponen-komponen pada larutan ideal (larutan-larutan encer) dapat digambarkan sebagai diagram seperti pada Gambar berikut:
C. Kenaikan Titik Didih ( Tb ) dan Penurunan Titik Beku ( Tf )
Pernahkah Anda mengukur suhu air mendidih dan air membeku? Bagaimana bila air yang dididihkan/dibekukan diberi zat terlarut, lebih rendah, sama, atau lebih tinggi titik didih dan titik bekunya dibanding titik didih dari titik beku air?
Titik didih air yang sering disebutkan 100°C adalah titik didih normal yaitu titik didih pada tekanan 760 mmHg. Samakah titik didih air di daerah Anda dengan titik didih air di puncak gunung yang lebih tinggi dari daerah Anda? Mengapa demikian?
Titik didih dan titik beku suatu zat cair dipengaruhi oleh tekanan udara luar. Suatu zat cair mendidih pada saat tekanan uap jenuh cairan sama dengan tekanan udara luar. Di puncak gunung tekanan udara luar lebih rendah sehingga untuk menyamakan tekanan uap jenuh zat cair yang didihkan lebih cepat tercapai, hal ini berarti titik didihnya lebih rendah.
Demikian halnya pengaruh zat terlarut dalam zat cair (pelarut). Pada tekanan udara luar 760 mmHg, air mendidih pada suhu 100°C. Dengan adanya zat terlarut menyebabkan penurunan tekanan uap larutan, sehingga
pada suhu 100°C larutan air belum mendidih karena tekanan uapnya belum mencapai 760 mmHg. Untuk mencapai tekanan uap 760 mmHg maka perlu dipanaskan lebih tinggi lagi akibatnya larutan mendidih pada suhu lebih dari 100°C. Ini berarti bahwa titik didih larutan lebih tinggi daripada titik didih pelarut murninya. Selisih antara titik didih larutan dengan titik didih pelarut murni disebut kenaikan titik didih (∆Tb ).
∆Tb = T b larutan + Tb pelarut
Sebaliknya pada titik beku normal karena tekanan uap larutan juga
lebih rendah daripada tekanan uap pelarut murni. Sehingga agar larutan
membeku, harus didinginkan akibatnya titik beku larutan lebih rendah
dari titik beku pelarut murni. Perubahan temperatur titik beku ini
disebut penurunan titik beku larutan (∆Tf ).
∆Tf = Tf pelarut – Tf larutan
Jadi, pengaruh zat terlarut nonelektrolit yang tidak mudah menguap
adalah menurunkan tekanan uap, menaikkan titik didih, dan menurunkan
titik beku.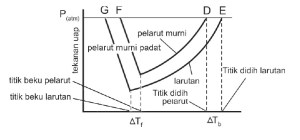
D. Tekanan Osmotik ( )
Bila dua larutan yang konsentrasinya berbeda, yang satu pekat dan yang lainnya encer dipisahkan oleh membran semipermiabel, maka molekulmolekul pelarut akan mengalir dari larutan yang lebih encer ke larutan yang lebih pekat, sedangkan molekul zat terlarut tidak mengalir. Hal ini terjadi karena partikel pelarut lebih kecil daripada partikel zat terlarut sehingga partikel pelarut dapat menembus membran semipermiabel dan partikel zat terlarut tidak. Aliran suatu pelarut dari suatu larutan dengan konsentrasi lebih rendah ke larutan dengan konsentrasi tinggi melalui membran semipermiabel disebut osmosis.
Pada larutan encer, kenaikan titik didih dan penurunan titik beku berbanding lurus dengan konsentrasi molal larutan.

Harga Kb dan Kf untuk beberapa pelarut dicantumkan pada Tabel berikut :
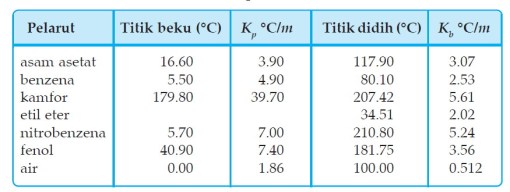
Dengan data tetapan titik didih dan titik beku molal kita dapat menentukan titik didih suatu larutan, konsentrasi larutan, dan massa molekul relatif.
D. Tekanan Osmotik (p)
Bila dua larutan yang konsentrasinya berbeda, yang satu pekat dan yang lainnya encer dipisahkan oleh membran semipermiabel, maka molekul-molekul pelarut akan mengalir dari larutan yang lebih encer ke larutan yang lebih pekat, sedangkan molekul zat terlarut tidak mengalir. Hal ini terjadi karena partikel pelarut lebih kecil daripada partikel zat terlarut sehingga partikel pelarut dapat menembus membran semipermiabel dan partikel zat terlarut tidak. Aliran suatu pelarut dari suatu larutan dengan konsentrasi lebih rendah ke larutan dengan konsentrasi tinggi melalui membran semipermiabel disebut osmosis.
Peristiwa osmosis dapat dicegah dengan memberi tekanan pada permukaan larutan. Tekanan yang diperlukan untuk mencegah terjadinya osmosis ini disebut tekanan osmotik. Tekanan osmotik bergantung pada konsentrasi dan bukan pada jenis partikel zat terlarut. Menurut Van’t Hoof, tekanan osmotik larutan encer dapat dihitung dengan rumus yang serupa dengan persamaan gas ideal.
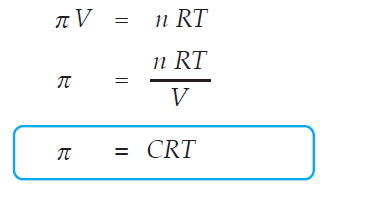
Keterangan :
p = tekanan osmotik (atm)
V = volume larutan (liter)
R = tetapan gas (0,082 L atm/mol K)
T = suhu mutlak (K)
Penerapan Tekanan Osmotik dan Osmosis
Selain menggunakan penurunan tekanan uap, kenaikan titik didih dan penurunan titik beku, pengukuran tekanan osmosis juga dapat digunakan untuk menentukan massa molekul relatif (Mr) suatu senyawa. Untuk larutan yang sangat encer, pengukuran tekanan osmotik lebih akurat dibanding pengukuran titik didih atau titik beku sehingga penentuan massa molekul relatif dengan mengukur tekanan osmotik akan lebih teliti. Peristiwa osmosis dapat dimanfaatkan untuk penyediaan cairan infus dan industri pengolahan air laut menjadi air tawar dengan osmosis balik.
Sifat Koligatif Larutan Elektrolit
Perbandingan sifat koligatif larutan elektrolit yang terukur dengan sifat koligatif larutan nonelektrolit yang diharapkan pada konsentrasi yang sama disebut faktor Van’t Hoff. (i). Dengan demikian untuk larutan elektrolit berlaku rumus-rumus sifat koligatif sebagai berikut:
∆Tb = m × Kb × i
∆Tf = m × Kf × i
p = m × R × T × i
dengan:
i = 1 + (n - 1).a
Catatan :n = banyaknya ion
a = derajat ionisasi
untuk elektrolit kuat (a= 1), harga i = n.









0 komentar:
Posting Komentar